CRISPR -редактирование генов в Т-лимфоцитах открывает новые возможности
Эффективная, дешевая и точная техника, говорят авторы данного исследования, стала концом долгого пути создания новой клеточной терапии.
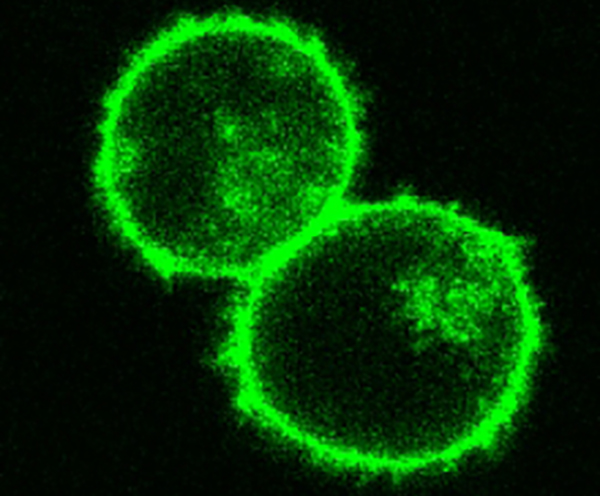
Команда ученых создала CRISPR ориентир, в результате чего протеин с зеленой флуоресценцией выражен только в определенных клеточных локализациях и структурах.
Для достижения этих выдающихся для науки, медицины и индустрии результатов, ученые из Калифорнийского Университета (Сан-Франциско) генетически запрограммировали иммунные клетки человека — Т-лимфоциты, используя не вирусы, а вставки ДНК. Ученые утверждают, что ожидают от своей техники быстрого, универсального и экономически достижимого использования технологии CRISPR (от англ. clustered regularly interspaced short palindromic repeats — короткие палиндромные повторы, регулярно расположенные группами) редактирования генов, которая широко используется в набирающей обороты области клеточной терапии, увеличивая шансы создания новых безопасных методов лечения рака, аутоиммунных и других заболеваний, включая редкие наследственные.
Новый метод, описанный в выпуске журнала «Nature» от 11 июля, предлагает для перезаписи последовательности генома в человеческих Т-лимфоцитах надежную молекулярную систему, работающую по принципу «вырезать и вставить». Он основывается на электропорации, процессе, при котором электрическое поле, примененное к клеткам, временно делает их мембраны более проницаемыми.
После года экспериментирования с тысячами величин, ученые Калифорнийского университета нашли точные количества Т-лимфоцитов, ДНК и CRISPR -ножниц, которые должны быть смешаны друг с другом для последующей их обработки электрическим полем, чтобы Т-лимфоцит смог получить из этих составляющих все необходимое, для точного интегрирования своего генома со специфической генной последовательностью, ьььюэхз.разработанной CRISPR-программой. «Это быстрый и легко приспосабливаемый к различным условиям метод, который может применяться для изменения, повышения функциональной активности и репрограммирования Т-клеток, поэтому мы может наделить их специфичностью, которая нам нужна для разрушения раковых клеток, для распознавания инфекций, а также для подавления чрезмерного иммунного ответа, наблюдаемого при аутоиммунных заболеваниях. Сейчас мы находимся у финишной ленты на всех этих фронтах», — сказал Алекс Марсон, доктор медицинских наук, доцент микробиологии и иммунологии, член центра исследования рака Хелен Диллер Калифорнийского университета и ведущий автор данного исследования.
Важны не столько скорость и простота использования новой технологии, сказал Марсон (который, кроме всего перечисленного выше, является научным руководителем центра биомедицины в Инновационном институте геномики), сколько то, что этот подход позволяет вставлять в Т-лимфоциты значительные участки ДНК, которые могут наделять клетки новыми мощными способностями. Сотрудники лаборатории Марсона уже имели до этого положительные результаты использования электропорации и CRISPR для закладывания частичек генетического материала в Т-лимфоциты, но до сегодняшнего момента все многочисленные попытки ученых разместить длинную последовательность ДНК внутрь Т-клеток приводили к их гибели, что заставляло думать, что длинные ДНК-последовательности высоко токсичны для лимфоцитов. Демонстрируя универсальность и эффективность нового метода, исследователи использовали его для исправления болезнетворных генетических мутаций в Т-лимфоцитах детей с редкими наследственными аутоиммунными заболеваниями, а также для создания Т-клеток, способных обнаруживать и уничтожать клетки меланомы человека. Вирусы вызывают инфекции инъецируя свой генетический материал через клеточные мембраны, и с 1970-х годов ученые использовали эту их способность, удаляя у вирусов вирулентность и используя полученные «вирусные векторы» для переноса ДНК в клетки для исследований, генной терапии, а также, для создания клеток CAR-T, используемых при иммунотерапии рака. Т-клеточная инженерия с использованием вирусов одобрена Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США для борьбы с некоторыми типами лейкемии и лимфомы. Но создание вирусных векторов — трудоемкий и дорогостоящий процесс, и это приводит к проблемам, как в лечении генетических заболеваний, так и в клеточно-опосредованной терапии. Но даже если вирусные векторы доступны, они далеки от идеала, потому что для них характерно бессимптомное встраивание генов в клеточный геном, что может вредить здоровым генам или может привести к неподчинению вновь введенных генов регулирующим механизмам, обеспечивающим нормальное функционирование клеток. Эти ограничения, потенциально приводящие к развитию серьезных побочных эффектов, становятся большой проблемой и в генной, и в клеточной терапии, в том числе и в CAR-T-иммунотерапии.
«Попытки внедрить новые гены в Т-клетки продолжались около тридцати лет», — сказал основной автор исследования Тео Рот, научный сотрудник программы Калифорнийского университета Medical Scientist Training, который разработал и провел данное исследование в лаборатории Марсона. «Теперь не нужно будет иметь шесть или семь человек в штате лаборатории, работающей с вирусами, только для того, чтобы спроектировать Т-клетки. Значит, мы увидим сотни лабораторий, занимающихся этими клетками, а не несколько, как это было раньше, и работать они смогут с ДНК-последовательностями все возрастающей сложности. Мы будем создавать как можно больше возможностей для того, чтобы ускорить развитие будущих методик клеточной терапии ».
После приблизительно года проб и ошибок Рот определил пропорции Т-клеточной популяции, количества ДНК и содержания CRISPR, которые взаимодействуя друг с другом и электрическим полем, обладающим определенными параметрами, приведут к эффективному и точному редактированию геномов Т-клеток. Подтверждая обнаруженные данные, Рот заставлял CRISPR категорировать наборы различных протеинов Т-клеток с зеленым флуоресцирующим протеином (GFP — green fluorescent protein), и результат был высокоспецифичным, с минимальным уровнем результатов «мимо цели»: каждый из CRISPR образцов внутриклеточных структур Рота соответствовал маркировке GFP, остальные же под микроскопом зеленым не светились. Затем, в дополнительных экспериментах, служащих доказательством перспективности новой терапевтической техники, Рот, Марсон и их коллеги показали, как она может потенциально использоваться для настройки Т-лимфоцитов против каких-то аутоиммунных заболеваний или рака.
В первом примере Рот и его коллеги использовали Т-клетки, предоставленные в лабораторию Марсона Йельской школой медицины Кевана Герольда. Клетки были получены от трех сибсов (братьев и сестер) с редким и тяжелым аутоиммунным заболеванием, которое до сих пор было устойчивым к лечению. Геномное секвенирование показало, что Т-клетки у этих детей несут мутации в гене IL2RA. Этот ген содержит инструкции для рецептора клеточной поверхности, необходимые для развития регуляторных Т-клеток, контролирующих другие иммунные клетки и предотвращающие аутоиммунитет.
С помощью невирусного метода CRISPR команда Калифорнийского университета смогла быстро восстановить дефект IL2RA в детских Т-клетках и восстановить клеточные сигналы, которые были нарушены мутациями. В CAR-T терапии Т-клетки, которые были удалены из организма, модифицированы для борьбы с раковыми клетками, затем возвращаются в организм для лечения опухолей. Исследователи надеются, что подобный подход может быть эффективным и для лечения аутоиммунных заболеваний, при которых нарушаются регуляторные клетки, таких, как у этих троих детей с мутациями IL2RA.
Во втором наборе экспериментов, проведенных в сотрудничестве с доктором философии Кристиной Пуиг-Саус и Антони Рибасом из Института иммунотерапии рака Паркера в Лос-Анджелесе, ученые полностью заменили рецепторы изначальных Т-клеток в популяции нормальных человеческих Т-клеток новыми рецепторами, которые были специально спроектированы для поиска определенного подтипа клеток меланомы человека. Т-клеточные рецепторы — это датчики, которые клетки используют для обнаружения болезни или инфекции, и, разглядывая контрольные чашки петри можно увидеть, как сконструированные клетки эффективно размещаются в мишенях — клетках меланомы, игнорируя другие клетки, проявляя выраженную специфичность, которая и является основной целью прецизионной медицины рака.
Без необходимости использования вирусов исследователи могут генерировать большое количество CRISPR-модифицированных клеток, перепрограммированных для отображения нового рецептора Т-клеток. При переносе на мышей, с имплантированными в них опухолями меланомы человека, сконструированные человеческие Т-клетки попадали на участок опухоли и проявляли противораковую активность. «Эта стратегия замены Т-клеточного рецептора может быть распространена на любой рецептор Т-клеток», — сказал Марсон. «С помощью этой новой техники мы можем вырезать и вставить в указанное место практически любой ген, переписывая нужную страницу в последовательности генома».